-抗CTLA-4候选抗体从设计上提升了治疗指数30倍以上,致力于CTLA-4介导调节性T细胞(Treg)清除以进一步提升患者疗效, 具备同类最佳潜力
-安全抗体SAFEbody® ADG126在10 mg/kg剂量下每3周给药一次与帕博利珠单抗联合,针对转移性微卫星稳定型(MSS)结直肠癌(CRC)的单臂2期试验中观察到强烈的疗效信号
-根据Simon两阶段的2期单臂临床试验设计,基于10 mg/kg剂量每3周一次的给药频率,安全抗体SAFEbody® ADG126与帕博利珠单抗联合疗法针对转移性微卫星稳定型结直肠癌拓展队列正在入组第二阶段的10例患者
-罗氏启动了安全抗体SAFEbody®ADG126原创三联强力疗法肝细胞癌一线治疗的随机1b/2期临床试验
-1.288亿美元的现金可支持公司至2025年底的运营活动
天演药业(以下简称”公司”或”天演”)(纳斯达克股票代码:ADAG)是一家平台驱动的临床阶段生物制药公司,致力于发现并开发以原创抗体为基石的新型疗法。公司今日公布了截至2023年6月30日止六个月的财务业绩及最新业务进展。
天演首席执行官、董事长兼研发总裁罗培志博士表示:”目前我们自研的抗CTLA-4项目临床数据表明,通过合适的给药方案可提高抗CTLA-4疗法治疗指数并释放其临床潜能,为与PD-1及与其他药物的联合治疗奠定基础。得益于优异的安全性和多次重复给药方案,我们在最初入组的患者包括冷肿瘤(如转移性微卫星稳定型结直肠癌)患者和PD-L1低表达患者及PD-1耐药性热肿瘤患者的身上观察到了令人印象深刻的临床缓解,体现了 CTLA-4 介导的 Treg 清除对于疗效结果至关重要。”
罗博士继续补充道:”这些安全性和有效性数据使我们能够首次在晚期/转移性微卫星稳定型结直肠癌患者这一特定肿瘤患者中评估 ADG126联用帕博利珠单抗的疗效,该单臂临床2期试验采用了Simon两阶段设计。我们非常高兴在第一阶段观察到强烈的疗效信号, 顺利进入第二阶段的患者入组工作,给药剂量为10 mg/kg,每3周一次。我们对突破抗CTLA-4 疗法的边界,致力于提高癌症治疗的能力充满信心。”
抗CTLA-4项目亮点
-
1b/2期数据表明,靶向独特表位的抗CTLA-4非掩蔽型新表位抗体NEObody™ ADG116在单一疗法以及与抗PD-1的联合疗法中均显示出良好的安全性与临床缓解。
-
ADG116单一疗法在最高剂量达到15 mg/kg(N=59)的试验中显示出良好的安全性。
-
在针对经过大量预治疗的肿瘤患者的治疗中,ADG116单一疗法的总缓解率(ORR)达到13%(3/23可评估),其中,肾细胞癌(RCC)患者与高度微卫星不稳定(MSI-H)型子宫内膜癌患者观察到确认的部分缓解(PR),卡波西氏肉瘤患者观察到初步缓解。
-
与抗PD-1疗法(N=22)的联合治疗试验结果表明,在剂量水平为3 mg/kg且每6周给药一次的剂量递增试验中,ADG116展现出可控的安全性与令人鼓舞的有效性。正在进行的联合治疗队列中观察到临床缓解,其中,一位头颈部鳞状细胞癌(HNSCC)患者在剂量水平为3 mg/kg(最初每3周给药,然后每6周给药)的ADG116与特瑞普利单抗联合治疗的重复给药试验中观察到持续超过一年的持久完全缓解(CR)(ORR = 20%;1/5可评估)。
-
此外,一位转移性微卫星稳定型结直肠癌患者在ADG116(剂量水平为3 mg/kg,每6周给药)与特瑞普利单抗联合治疗的重复给药试验中观察到初步部分缓解。
-
ADG116已观察到临床疗效,并准备在合理配备资源后进入随机2期试验,其目前正在进行剂量扩展试验,以评估ADG116与抗PD-1药物联合治疗的疗效。
-
来自高剂量重复给药试验的ADG126 1b/2期临床数据表明,与ADG116靶向同一独特表位的精准掩蔽型抗CTLA-4安全抗体SAFEbody® ADG126在单一治疗与联合疗法中均展现出令人信服的安全性与良好的有效性:
-
2023年美国癌症协会(AACR)年会上公布的数据显示,在针对晚期/转移性实体瘤患者最高剂量为20 mg/kg且每三周重复给药的单一疗法剂量递增试验中,ADG126展现出良好的耐受性,未观察到剂量限制性毒性与3级或以上治疗相关不良事件(N=30)。
-
在与抗PD-1药物联合疗法(N=31)中,包括每3周或6周以10 mg/kg的剂量水平重复给药超过4个周期,ADG126也表现出与抗PD-1药物双联的同类最佳的安全性,未来有望与其他药物三联使用。
-
美国癌症协会年会上公布的数据显示,ADG126(剂量水平10 mg/kg)在与特瑞普利单抗联合治疗中展现出强大的有效性,包括在肛门鳞状细胞癌患者和阴茎鳞状细胞癌患者中观察到两例确认的部分缓解,以及在冷肿瘤(包括肝转移的转移性微卫星稳定型结直肠癌)患者中观察到明显肿瘤萎缩(靶病灶缩小≥20% )和持续病情稳定。
-
美国癌症协会年会上公布的数据显示,另一例确认部分缓解来自一位高度微卫星不稳定型子宫内膜癌患者,该患者接受了剂量水平为10 mg/kg的ADG126与抗PD-1抑制剂帕博利珠单抗的联合治疗。
-
在美国癌症协会年会之后,接受ADG126(剂量水平10 mg/kg)与帕博利珠单抗联合治疗的剂量拓展队列,在转移性微卫星稳定型结直肠癌患者外,又观察到另两例确认的临床缓解。
-
一例确认部分缓解来自一位宫颈癌患者,该患者在既往两线治疗(包含9个周期的帕博利珠单抗单一治疗)后出现疾病进展,符合PD-1耐药标准。
-
一位头颈部鳞状细胞癌患者观察到确认部分缓解以及靶病灶完全萎缩。患者既往未接受过免疫治疗,CPS评分较低。
-
在剂量递增试验阶段接受剂量水平为10 mg/kg且每3周给药的ADG126与抗PD-1联合治疗的可评估患者中,观察到40%的总缓解率(4/10),以及10%的3级治疗相关不良事件概率,未观察到3级以上治疗相关不良事件,也未观察到剂量限制性毒性。在每6周10 mg/kg和每3周6 mg/kg的给药频率和剂量下同样也观察到了临床疗效。
-
针对无肝转移的微卫星稳定型晚期结直肠癌的剂量扩展队列采用了两组给药方案:分别是ADG126,10 mg/kg,每6周给药(10名患者)联合帕博利珠单抗治疗,及ADG126 10 mg/kg,每3周给药(13名患者)联合帕博利珠单抗治疗。基于10 mg/kg剂量水平每3周给药一次的给药频率下观察到更有力的疗效信号,根据Simon两阶段的二期单臂临床试验设计,公司需要在该给药方案下继续招募10例患者,其初步有效性数据评估及统计分析预计将于2023年底或2024年初公布。
其它最新动态
-
罗氏: 根据2022年12月签订的临床试验合作协议,罗氏启动了一项跨国1b/2期临床试验,对照罗氏的阿替利珠单抗和贝伐珠单抗的标准治疗方案,评估ADG126联合阿替利珠单抗和贝伐珠单抗之三联免疫疗法在晚期肝细胞癌(HCC)的一线治疗中的有效性与安全性。该随机试验目前已启动患者入组工作,计划纳入多达60名患者,利用罗氏肿瘤免疫治疗开发平台MORPHEUS项目的全球临床试验网络。罗氏正赞助并开展该试验,天演将保留对ADG126的全球开发与商品化权利。
-
Exelixis:根据双方为开发原创掩蔽型抗体偶联药物而达成的技术授权协议,2023年6月,天演在第二个合作项目中成功筛选到目标安全抗体SAFEbody®候选药物,并获得一笔来自Exelixis的300万美元里程碑付款。
-
赛诺菲:天演与赛诺菲延续双方于2022年3月达成的合作,开发双特异性和单克隆SAFEbody®候选抗体,利用天演的技术制备的临床前候选抗体,由赛诺菲进行开发和商品化。
-
ADC Therapeutics (ADCT):截至本公告发布之日,ADCT与天演于2019年4月签订的生物材料转移与合作协议已经到期,ADCT选择不行使其对相关许可协议的选择权。未来,双方将保持开放态度,继续探索在创新抗体疗法的发现和开发方面的合作机会。
-
ADG153(抗CD47 IgG1安全抗体SAFEbody®):天演在美国癌症协会年会上公布的数据显示,ADG153在临床前研究中展现出同类最佳潜力,ADG153是一种IgG1亚型候选抗体,采用安全抗体SAFEbody®精准掩蔽技术优化其安全性,正处于新药申请的临床前研究。该海报展示总结了相关数据,表明ADG153在实体瘤模型中展现出强大的体内抗肿瘤活性,且优先在肿瘤微环境中与CD47靶点结合,因而具备出众的安全性。ADG153具有很强的抗体依赖性细胞介导的细胞毒性作用(ADCC)和抗体依赖性细胞介导的吞噬作用(ADCP),旨在充分释放抗 CD47 治疗血液肿瘤和实体恶性肿瘤的潜力。
-
董事会最新动态:今年8月,天演任命朱力博士为董事会成员。朱博士自2020年起担任金斯瑞及传奇生物科技有限公司(Legend Biotech)董事,目前是金斯瑞生物科技有限公司(Genscript Biotech Corporation)的首席战略官,其在企业战略、战略合作及联盟管理方面拥有着丰富的经验,尤其在传奇生物(金斯瑞的子公司)和跨国药企战略合作谈判的早期阶段发挥了关键作用。
-
此外,杜方勇博士,2020年起任天演首席技术官,因个人原因退出董事会。同时,公司任命天演创始团队成员,生物信息科技高级副总裁李艳担任董事一职。
-
今年早些时候,天演公布了董事会的最新动态:Mervyn Turner博士,默沙东研究实验室(Merck research Laboratories)前全球许可和外部研究部门负责人,被任命为董事;王雨濛接替孙乐非担任由泛大西洋投资集团新加坡办事处(General Atlantic Singapore AI Pte. Ltd)指定的董事;刘毓文因首次任期届满,辞去董事会及审计委员会成员职务。
-
科学顾问委员会:今年3月,医学博士Aurélien Marabelle教授被任命为公司科学顾问委员会成员。Marabelle教授是法国Gustave Roussy癌症中心药物开发部(DITEP)的医学科学家,也是肿瘤学和免疫学领域的专家。他在肿瘤特异性调节性T细胞(Treg)清除方面拥有深刻见解,开创性地引入肿瘤内而非系统给药抗CTLA-4疗法,从而克服抗CTLA-4疗法剂量依赖性毒性问题。
财务亮点
现金和现金等价物
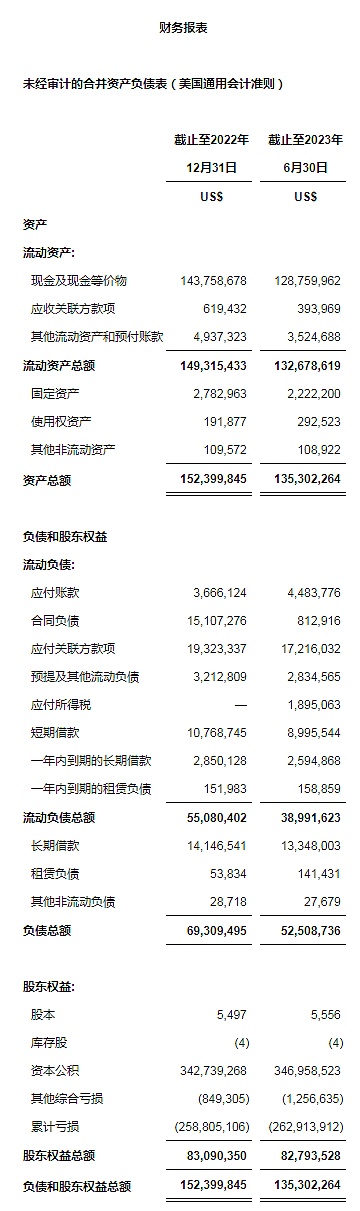
现金和现金等价物2022年12月31日约14,380万美元,2023年6月30日约12,880万美元。
截至2023年6月30日,公司从中国境内各商业银行获得的人民币贷款由2022年12月31日的2,780万美元减少至2023年6月30日的2,490万美元。从贷款中所获得资金主要用来支付公司在中国境内产生的研发费用,包括在临床及临床前研发项目中产生的CMC费用。
净收入
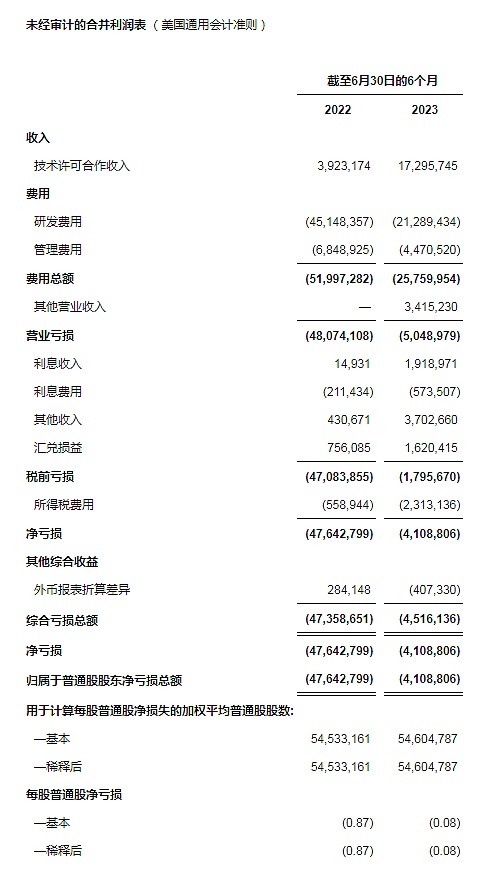
净收入同比增长了约341%。净收入相较于2022年同期的390万美元增加到2023年6月30日1,730万美元。该增长包含了因公司履行了与赛诺菲和Exelixis所分别签订的技术合作和授权协议中的履约义务而确认的收入。净收入也包含了于2023年6月从Exelixis收到的300万美元里程碑付款。
研发费用
研发费用同比下降了约53%。研发费用相较于2022年同期的4,510万美元下降到2023年6月30日的2,130万美元。该下降源于临床前项目支出的减少和ADG106相关的临床项目的逐渐收尾,与针对抗CTLA-4疗法增加的投入所抵消。公司重点发展优质临床项目,并采取了包括减少人员成本在内的一系列成本控制措施。
管理费用
管理费用相较于2022年同期的680万美元减少到2023年6月30日的450万美元。管理费用的减少主要是由于成本控制带来的人工及办公成本的减少。
其他营业收入
其他营业收入2023年6月30日约340万美元。其他营业收入包含了从一家合同制造商处获得的,针对公司在一份临床前项目外包协议中产生的损失的一次性补偿款。
净亏损
净亏损相较于2022年同期的4,760万美元减少到2023年6月30日的410万美元。
流通在外普通股
截止至2023年6月30日,公司流通在外的普通股为54,793,339股。每一股美国存托股票(ADS)可换算为1.25股普通股。
非美国通用会计准则(Non-GAAP)下的亏损
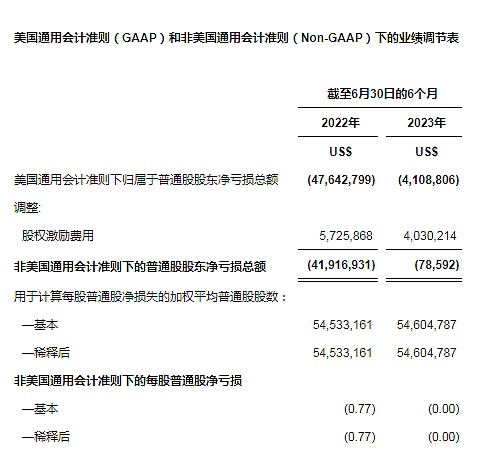
非美国通用会计准则下的净亏损定义为该期间的美国通用会计准则下的净亏损剔除股权激励费用。该金额从2022年同期的净亏损4,190万美元,下降至2023年6月30日的10万美元。请参阅本新闻稿中题为”美国通用会计准则(GAAP)和非美国通用会计准则(Non-GAAP)下的业绩调节表”部分了解详情。
天演药业使用Non-GAAP净亏损和Non-GAAP的每股普通股净亏损,用于评估本公司的经营成果,以及财务和经营决策。本公司认为,Non-GAAP净亏损和Non-GAAP的每股普通股净亏损有助于识别本公司业务的基本趋势,而这些趋势可能因本公司计入本期间亏损的某些费用的影响而扭曲。本公司认为,Non-GAAP净亏损和Non-GAAP的每股普通股净亏损提供了有关其经营成果的有用信息,整体提升了对其过去业绩和未来前景的全面了解,并使管理层在财务和运营决策中使用的关键指标更具可见性。
对于本期间的Non-GAAP财务指标的衡量,天演药业使用的Non-GAAP净亏损和Non-GAAP的每股普通股净亏损不应单独被考虑,也不应被视为该期间营业利润、净亏损或任何其他业绩衡量指标的替代品,或作为其经营业绩的衡量指标。公司鼓励投资者审阅该期间的Non-GAAP净亏损和Non-GAAP的每股普通股净亏损,并审阅最直接可比的美国通用会计准则下财务指标的调整过程。此处所列期间的Non-GAAP净亏损和Non-GAAP的每股普通股净亏损可能无法与其他公司提供的类似名称的财务指标相比较。其他公司可能会以不同的方式计算类似的财务指标,从而限制了它们作为公司可比数据的有用性。天演药业鼓励投资者和其他人全面审阅本公司的财务信息,而不是仅仅关注于单一的财务指标。
本期间计算的净利润指标下Non-GAAP净亏损和Non-GAAP的每股普通股净亏损,不包括股权激励费用。股权激励费用是向员工授予股票激励所产生的非现金费用。我们认为美国通用会计准则和非美国通用会计准则的调整信息能对管理层和投资人在进行公司运营表现的同期比较以及同业比较时有所助益。其原因有:(i)在某特定期间内的股权激励费用与公司的运营表现未必直接相关;(ii)因公司授予新的股权激励计划的时间安排,股权激励费用在不同期间内可能会发生较大变化;以及,(iii)其他公司可能采取不同的股权激励形式或者使用不同的估值方法。
请参阅本公告结尾的 “美国通用会计准则(GAAP)和非美国通用会计准则(Non-GAAP)下的业绩调节表”,获取本期间Non-GAAP净亏损和Non-GAAP的每股普通股净亏损的完整的调整过程。
关于天演药业
天演药业(纳斯达克股票代码:ADAG)是平台驱动并拥有自主平台产出的临床产品开发阶段的生物制药公司,公司致力于发现并开发以原创抗体为基石的新型癌症免疫疗法。借力于计算生物学与人工智能,凭借其全球首创的三体平台技术(新表位抗体NEObody™,安全抗体SAFEbody®及强力抗体POWERbody™),天演药业已建立起聚焦于新型肿瘤免疫疗法的独特原创的抗体产品线,以解决尚未满足的临床需求。天演已和多个全球知名合作伙伴达成了战略合作关系,并以其多种原创前沿科技为合作伙伴的新药研发赋能。
如需了解更多信息,请访问: https://investor.adagene.com 并关注天演药业微信、领英及推特官方帐号。
SAFEbody® 为天演在美国、中国、澳大利亚、日本、新加坡和欧盟的注册商标。
安全港声明
本新闻稿包含前瞻性陈述,包括关于临床数据对患者的潜在影响的陈述,以及天演药业的推进和预期的临床前活动、临床开发、监管里程碑以及其候选产品的商业化。由于各种重要因素,包括但不限于天演药业证明其候选药物的安全性和有效性的能力,实际结果可能与前瞻性陈述中所示的结果存在重大差异;其候选药物的临床结果,可能不支持进一步开发或监管批准;相关监管机构就天演药业候选药物的监管批准做出决定的内容和时间;如果获得批准,天演药业为其候选药物取得商业成功的能力;天演药业为其技术和药物获得和维持知识产权保护的能力;天演药业依赖第三方进行药物开发、制造和其他服务;天演药业有限的经营历史以及天演药业获得额外运营资金以及完成其候选药物的开发和商业化的能力;天演药业在其现有战略伙伴关系或合作之外签订额外合作协议的能力,以及COVID-19 流行对天演药业临床开发、商业和其他运营的影响,以及在天演提交给美国证券交易委员会的20-F形式的2022年的年度报告中”风险因素”部分更充分讨论的那些风险。所有前瞻性陈述均基于天演药业当前可获得的信息,除非依照法律之可能要求,天演药业不承担因新信息、未来事件或其他原因而公开更新或修改任何前瞻性陈述的义务。
白话区块链|同步全球区块链资讯、区块链快讯、区块链新闻
本站所有文章数据来源:金色财经
本站不对内容真实性负责,如需转载请联系原作者
如需删除该文章,请发送本文链接至oem1012@qq.com


